Pentru a descărca sau a imprima această pagină într-o altă limbă, alegeți mai întâi limba din meniul derulant din stânga sus.

Document de poziție IAOMT privind cavitațiile maxilarului uman
Președinte al Comitetului de patologie a maxilarului: Ted Reese, DDS, MAGD, NMD, FIAOMT
Karl Anderson, DDS, MS, NMD, FIAOMT
Patricia Berube, DMD, MS, CFMD, FIAOMT
Jerry Bouquot, DDS, MSD
Teresa Franklin, dr
Jack Kall, DMD, FAGD, MIAOMT
Cody Kriegel, DDS, NMD, FIAOMT
Sushma Lavu, DDS, FIAOMT
Tiffany Shields, DMD, NMD, FIAOMT
Mark Wisniewski, DDS, FIAOMT
Comitetul ar dori să-și exprime aprecierea lui Michael Gossweiler, DDS, MS, NMD, Miguel Stanley, DDS și Stuart Nunally, DDS, MS, FIAOMT, NMD pentru criticile lor la adresa acestei lucrări. De asemenea, dorim să recunoaștem contribuțiile neprețuite și efortul depus de dr. Nunnally în elaborarea documentului de poziție din 2014. Munca, diligența și practica sa au constituit coloana vertebrală pentru această lucrare actualizată.
Aprobat de Consiliul de Administrație al IAOMT în septembrie 2023
Cuprins
Tomografia computerizată cu fascicul conic (CBCT)
Biomarkeri și examen histologic
Considerații în evoluție în scopuri de diagnostic
Evaluarea meridianului prin acupunctură
Implicații sistemice și clinice
Strategii alternative de tratament
Referinte
Anexa I Rezultatele sondajului IAOMT 2
Anexa II Rezultatele sondajului IAOMT 1
Anexa III imagini
Figura 1 Osteonecroza degenerativă grasă a osului maxilar (FDOJ)
Figura 2 Citokine în FDOJ în comparație cu controale sănătoase
Figura 3 Procedura chirurgicală pentru un FDOJ retromolar
Figura 4 Chiuretaj și radiografia corespunzătoare a FDOJ
Filme Clipuri video de intervenții chirurgicale ale maxilarului la pacienți
În ultimul deceniu a existat o conștientizare tot mai mare în rândul publicului și al furnizorilor de servicii de sănătate cu privire la legătura dintre sănătatea orală și cea sistemică. De exemplu, boala parodontală este un factor de risc atât pentru diabet, cât și pentru bolile cardiace. O legătură potențial consecință și din ce în ce mai cercetată a fost demonstrată, de asemenea, între patologia maxilarului și sănătatea generală și vitalitatea individului. Utilizarea unor modalități de imagistică avansate din punct de vedere tehnic, cum ar fi tomografia computerizată cu fascicul conic (CBCT) au fost esențiale în identificarea patologiilor maxilarului, care au condus la îmbunătățirea capacităților de diagnosticare și la o capacitate îmbunătățită de a evalua succesul intervențiilor chirurgicale. Rapoartele științifice, docudramele și rețelele sociale au sporit gradul de conștientizare a publicului cu privire la aceste patologii, în special în rândul acelor indivizi care suferă de afecțiuni neurologice sau sistemice cronice inexplicabile care nu reușesc să răspundă la intervențiile medicale sau stomatologice tradiționale.
Academia Internațională de Medicină Orală și Toxicologie (IAOMT) se bazează pe convingerea că știința ar trebui să fie baza pe care să fie alese și utilizate toate modalitățile de diagnostic și tratament. Cu această prioritate în minte: 1) oferim această actualizare a documentului nostru de poziție IAOMT Jawbone Osteonecrosis din 2014 și 2) propunem, pe baza observației histologice, o denumire mai precisă din punct de vedere științific și medical pentru boala, în special, Boala medulară ischemică cronică. al maxilarului (CIMDJ). CIMDJ descrie o afecțiune osoasă caracterizată prin moartea componentelor celulare ale osului spongios, secundară unei întreruperi a aportului de sânge. De-a lungul istoriei sale, ceea ce ne referim ca CIMDJ a fost denumit printr-o multitudine de nume și acronime care sunt enumerate în Tabelul 1 și vor fi discutate pe scurt mai jos.
Scopul și intenția acestei academii și a lucrării este de a oferi știință, cercetare și observații clinice pentru pacienți și clinicieni pentru a lua decizii informate atunci când iau în considerare aceste leziuni CIMDJ, care sunt adesea denumite cavitații ale maxilarului. Această lucrare din 2023 a fost elaborată într-un efort comun care a inclus clinicieni, cercetători și un eminent patolog maxilar, dr. Jerry Bouquot, în urma revizuirii a peste 270 de articole.
În niciun alt os, potențialul de traume și infecții nu este la fel de mare ca în oasele maxilare. O trecere în revistă a literaturii referitoare la subiectul cavitațiilor maxilarului, (adică, CIMDJ) arată că această afecțiune a fost diagnosticată, tratată și cercetată încă din anii 1860. În 1867, dr. HR Noel a oferit o prezentare intitulată O prelegere despre carii și necroza osoasă la Colegiul de Chirurgie Dentală din Baltimore, iar în 1901 cavitațiile maxilarului sunt discutate pe larg de William C. Barrett în manualul său intitulat Oral Pathology and Practice: A Textbook for the Use of Students in Dental Colleges and a Handbook for Dental Practitioners . GV Black, numit adesea părintele stomatologiei moderne, a inclus o secțiune în manualul său din 1915, Special Dental Pathology, pentru a descrie „aspectul obișnuit și tratamentul” a ceea ce el a descris ca osteonecroză a maxilarului (JON).
Cercetările privind cavitațiile oaselor maxilare au părut să se oprească până în anii 1970, când alții au început să cerceteze acest subiect, folosind o varietate de nume și etichete și să publice informații despre aceasta în manualele moderne de patologie orală. De exemplu, în 1992, Bouquot și colab. au observat inflamație intraosoasă la pacienții cu dureri faciale cronice și severe (N=135) și au inventat termenul „Osteonecroză cavitațională care induce nevralgie” sau NICO. Deși Bouquot și colab. nu au comentat etiologia bolii, au ajuns la concluzia că este probabil ca leziunile să inducă o nevralgie facială cronică cu caracteristici locale unice: formarea cavității intraosoase și necroză osoasă de lungă durată cu vindecare minimă. Într-un studiu clinic al pacienților cu nevralgie de trigemen (N=38) și facială (N=33), Ratner și colab., au arătat, de asemenea, că aproape toți pacienții aveau cavități în osul alveolar și maxilarul. Cavitățile, uneori cu diametrul mai mare de 1 centimetru, se aflau în locurile extracțiilor anterioare ale dinților și, în general, nu erau detectabile cu raze X.

 O varietate de alți termeni pentru ceea ce identificăm ca CIMDJ există în literatură. Acestea sunt enumerate în Tabelul 1 și discutate pe scurt aici. Adams și colab. au inventat termenul de osteomielită fibroasă cronică (CFO) într-o lucrare de poziție din 2014. Documentul de poziție a fost rezultatul unui consorțiu multidisciplinar de practicieni din domeniile Medicină orală, endodonție, patologie orală, neurologie, reumatologie, otorinolaringologie, parodontologie, psihiatrie, radiologie orală și maxilo-facială, anestezie, stomatologie generală, medicină internă și managementul durerii. . Obiectivul grupului a fost de a oferi o platformă interdisciplinară pentru a trata bolile asociate cu capul, gâtul și fața. Prin eforturile colective ale acestui grup, căutări ample de literatură și interviuri cu pacienții, a apărut un model clinic distinct, pe care l-au numit CFO. Ei au remarcat că această boală este adesea nediagnosticată din cauza comorbidităților sale cu alte afecțiuni sistemice. Acest grup a subliniat legăturile potențiale dintre boală și problemele sistemice de sănătate și necesitatea unei echipe de medici care să diagnosticheze și să trateze corect pacientul.
O varietate de alți termeni pentru ceea ce identificăm ca CIMDJ există în literatură. Acestea sunt enumerate în Tabelul 1 și discutate pe scurt aici. Adams și colab. au inventat termenul de osteomielită fibroasă cronică (CFO) într-o lucrare de poziție din 2014. Documentul de poziție a fost rezultatul unui consorțiu multidisciplinar de practicieni din domeniile Medicină orală, endodonție, patologie orală, neurologie, reumatologie, otorinolaringologie, parodontologie, psihiatrie, radiologie orală și maxilo-facială, anestezie, stomatologie generală, medicină internă și managementul durerii. . Obiectivul grupului a fost de a oferi o platformă interdisciplinară pentru a trata bolile asociate cu capul, gâtul și fața. Prin eforturile colective ale acestui grup, căutări ample de literatură și interviuri cu pacienții, a apărut un model clinic distinct, pe care l-au numit CFO. Ei au remarcat că această boală este adesea nediagnosticată din cauza comorbidităților sale cu alte afecțiuni sistemice. Acest grup a subliniat legăturile potențiale dintre boală și problemele sistemice de sănătate și necesitatea unei echipe de medici care să diagnosticheze și să trateze corect pacientul.
Leziunile cavitaționale ale maxilarului au fost observate și la copii. În 2013, Obel și colab. au descris leziuni la copii și au inventat termenul de Osteomielita cronică mandibulară juvenilă (JMCO). Acest grup a sugerat posibila utilizare a bifosfonaților intravenos (IV) ca tratament pentru acești copii. În 2016, Padwa și colab. au publicat un studiu care descrie o osteită inflamatorie sterilă focală la oasele maxilarului pacienților pediatrici. Ei au etichetat leziunea Osteomielita cronică nebacteriană pediatrică (CNO).
Din 2010, dr. Johann Lechner, cel mai publicat autor și cercetător privind leziunile cavitaționale ale maxilarului, și alții cercetează relația acestor leziuni cu producția de citokine, în special citokinele inflamatorii RANTES (cunoscută și sub numele de CCL5). Dr. Lechner a folosit diverși termeni pentru a descrie aceste leziuni care au inclus NICO menționat anterior, dar și Osteonecroza ischemică aseptică la nivelul maxilarului (AIOJ) și Osteonecroza degenerativă grasă a maxilarului (FDOJ). Descrierea/eticheta lui se bazează pe aspectul fizic și/sau starea macroscopic patologică observată clinic sau intraoperator.
Acum este nevoie de a clarifica o altă patoză a maxilarului identificată mai recent, care este diferită de subiectul acestei lucrări, dar ar putea fi confuză pentru cei care cercetează leziunile cavitaționale. Acestea sunt leziuni osoase ale maxilarului care apar ca urmare a utilizării produselor farmaceutice. Leziunile se caracterizează cel mai bine prin pierderea aportului de sânge cu sechestrarea ulterioară necontrolată a osului. Aceste leziuni au fost denumite ulcerație orală cu sechestrare osoasă (OUBS) de către Ruggiero și colab. într-un document de poziție pentru Asociația Americană a Chirurgilor Orali și Maxilo-faciali (AAOMS), precum și de către Palla și colab., într-o revizuire sistematică. Deoarece această problemă este legată de utilizarea fie a unuia sau a mai multor produse farmaceutice, IAOMT este de părere că acest tip de leziune este cel mai bine descris ca Osteonecroza maxilarului legată de medicamente (MRONJ). MRONJ nu va fi discutat în această lucrare, deoarece etiologia și abordările sale de tratament sunt diferite de cele la care ne referim ca CIMDJ și a fost studiat anterior pe larg.
Utilizarea din ce în ce mai frecventă a radiografiilor de tomografie computerizată cu fascicul conic (CBCT) de către mulți medici dentari a condus la o creștere a respectării cavitațiilor intramedulare pe care le numim CIMDJ și care au fost trecute cu vederea și, prin urmare, ignorate. Acum că aceste leziuni și anomalii sunt mai ușor identificate, devine responsabilitatea profesiei stomatologice să diagnosticheze boala și să ofere recomandări de tratament și îngrijire.
Aprecierea și identificarea existenței CIMDJ este punctul de plecare al înțelegerii acestuia. Indiferent de numeroasele nume și acronime care au fost asociate cu patologia, prezența osului necrotic sau pe moarte în componenta medulară a osului maxilar este bine stabilită.
Când sunt observate în timpul intervenției chirurgicale, aceste defecte osoase se prezintă în numeroase moduri. Unii practicieni raportează că peste 75% dintre leziuni sunt complet goale sau umplute cu țesut moale, maro-gri și demineralizat/granulomatis, adesea cu material uleios galben (chisturi uleioase) găsit în zonele defecte cu anatomia osoasă normală înconjurătoare. Alții raportează prezența cavitațiilor care au o densitate osoasă corticală acoperită variabilă care, la deschidere, par să aibă căptușeală cu materiale filamentoase fibroase negre, maro sau gri. Încă alții raportează modificări semnificative descrise în mod variat ca „grumpoase”, „ca rumeguș”, „cavități goale” și „uscate” cu duritate ocazională sclerotică, asemănătoare dintelui, a pereților cavității. La examinarea histologică, aceste leziuni par similare cu necroza care apare în alte oase ale corpului și sunt histologic diferite de osteomielita (vezi Figura 1). Imagini suplimentare care ilustrează boala CIMDJ, unele de natură grafică, sunt incluse în Anexa III la sfârșitul acestui document.
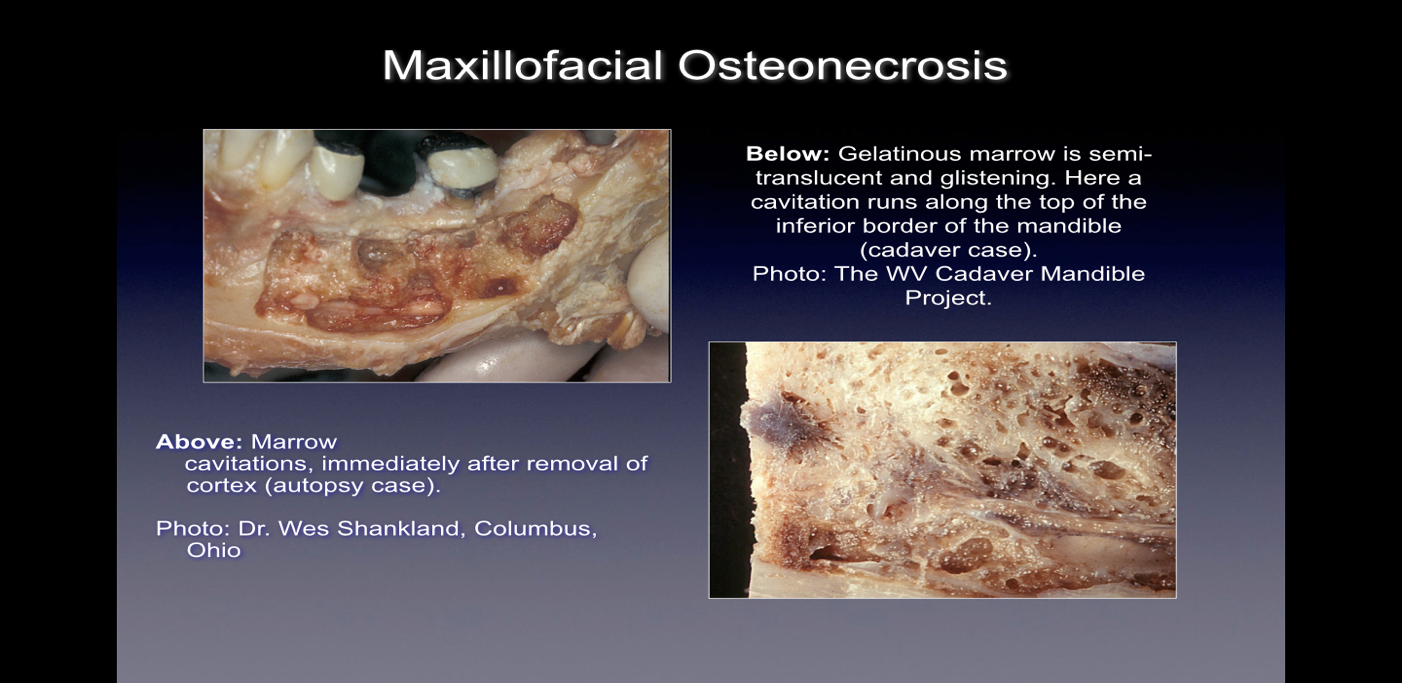
Figura 1 Imagini ale CIMDJ luate dintr-un cadavru
La fel ca alți practicieni din domeniul sănătății, stomatologii folosesc un proces organizat care utilizează diverse metode și modalități pentru a diagnostica leziunile cavitaționale. Acestea pot consta în efectuarea unui examen fizic care include efectuarea unui istoric de sănătate, evaluarea simptomelor, obținerea de fluide corporale pentru efectuarea testelor de laborator și obținerea de probe de țesut pentru biopsie și testare microbiologică (adică testarea prezenței agenților patogeni). Tehnologiile de imagistică, cum ar fi CBCT, sunt, de asemenea, adesea utilizate. La pacienții cu tulburări complexe care nu urmează întotdeauna un model sau nu se potrivesc cu o ordine tipică a unui complex de simptome, procesul de diagnosticare poate necesita o analiză mai detaliată care la început ar putea duce doar la un diagnostic diferențial. Mai jos sunt prezentate scurte descrieri ale mai multor dintre aceste modalități de diagnosticare.
Tomografia computerizată cu fascicul conic (CBCT)
Tehnicile de diagnostic descrise încă din 1979 de Ratner și colegii săi, utilizând palparea digitală și presiunile, injecțiile diagnostice cu anestezic local, luarea în considerare a istoricului medical și localizarea durerii radiante sunt utile în diagnosticarea cavitațiilor maxilarului. Cu toate acestea, în timp ce unele dintre aceste leziuni provoacă durere, umflături, roșeață și chiar febră, altele nu. Astfel, o măsură mai obiectivă, cum ar fi imagistica, este adesea necesară.
Cavitațiile nu sunt de obicei detectate pe filme radiografice bidimensionale standard (2-D, cum ar fi, periapicale și panoramice), care sunt utilizate în mod obișnuit în stomatologie. Ratner și colegii săi au arătat că 40% sau mai mult din os trebuie modificat pentru a prezenta modificări, iar acest lucru este susținut de lucrările ulterioare și ilustrat în Figura 2. Acest lucru este legat de limitarea inerentă a imagistică 2-D care provoacă suprapunerea. a structurilor anatomice, mascând zonele de interes. În cazul defectelor sau patologiei, în special la nivelul mandibulei, efectul de mascare al osului cortical dens asupra structurilor subiacente poate fi semnificativ. Prin urmare, sunt necesare tehnici de imagistică avansate din punct de vedere tehnologic, cum ar fi CBCT, scanări Tech 99, imagistica prin rezonanță magnetică (RMN) sau ecografie trans-alveolară cu ultrasunete (CaviTAU™®).
Dintre diferitele tehnici imagistice care sunt disponibile, CBCT este cel mai utilizat instrument de diagnostic folosit de stomatologii implicați în diagnosticarea sau tratarea cavitațiilor și, prin urmare, cel pe care îl vom discuta în profunzime. Piatra de temelie a tehnologiei CBCT este capacitatea sa de a vizualiza o leziune de interes în 3 dimensiuni (frontal, sagital, coronal). CBCT s-a dovedit a fi o metodă fiabilă și precisă de identificare și estimare a mărimii și extinderii defectelor intra-oase ale maxilarului, cu mai puțină distorsiune și mai puțină mărire decât razele X 2D.
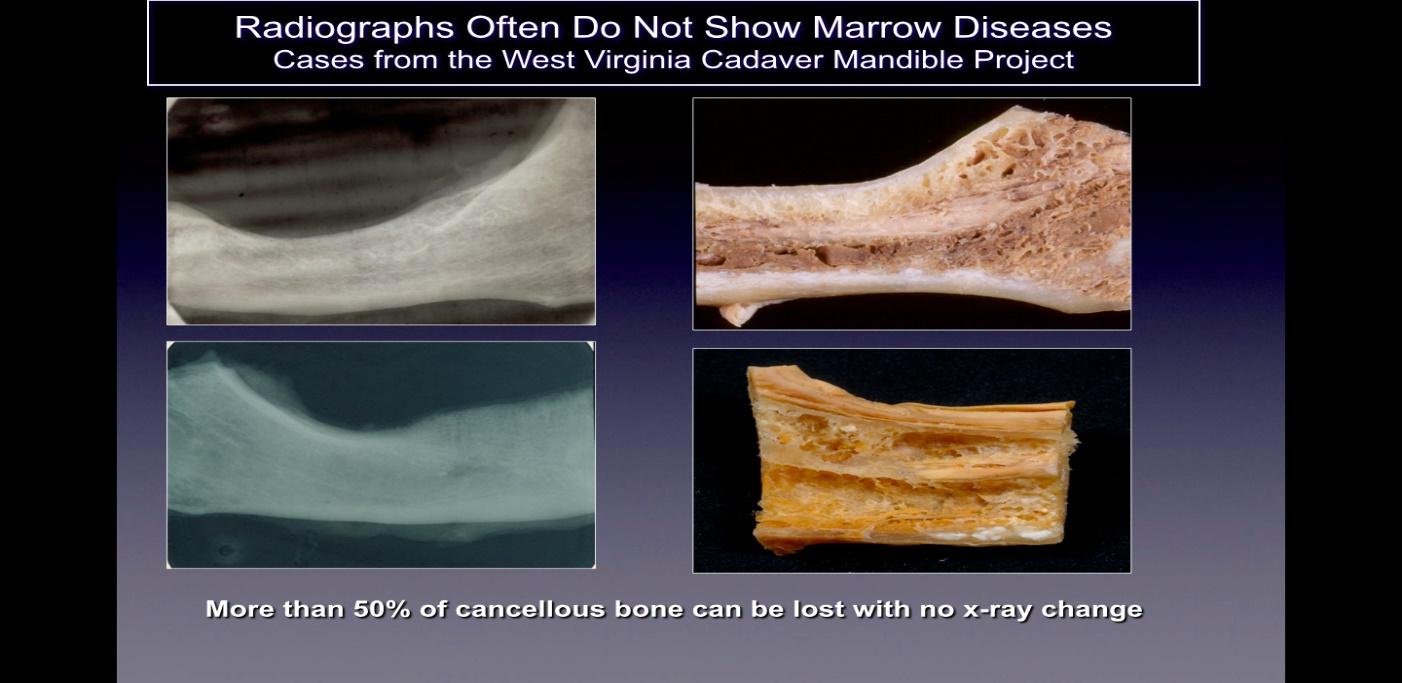
Figura 2 Legendă: În partea stângă sunt prezentate radiografii 2-D ale oaselor maxilarului luate de la cadavrele care apar
sănătos. În partea dreaptă a figurii sunt fotografii ale acelorași oase maxilare care arată cavitația necrotică evidentă.
Figura adaptată după Bouquot, 2014.
Studiile clinice au arătat că imaginile CBCT ajută, de asemenea, la determinarea conținutului unei leziuni (plin de lichid, granulomat, solid etc.), posibil contribuind la distingerea între leziuni inflamatorii, tumori odontogenice sau neodontogenice, chisturi și alte benigne sau maligne. leziuni .
Software-ul dezvoltat recent, care este integrat în mod specific cu diferite tipuri de dispozitive CBCT, utilizează unități Hounsfield (HU), care permite o evaluare standardizată a densității osoase. HU reprezintă densitatea relativă a țesuturilor corporale conform unei scale de gri calibrate, bazată pe valori pentru aer (-1000 HU), apă (0 HU) și densitatea osoasă (+1000 HU). Figura 3 prezintă diferite vederi ale unei imagini CBCT moderne.
Pentru a rezuma, CBCT sa dovedit util în diagnosticul și tratamentul cavitațiilor maxilarului prin:
- Identificarea dimensiunii, extinderii și poziției 3-D a unei leziuni;
- Identificarea apropierii unei leziuni de alte structuri anatomice vitale din apropiere, cum ar fi
nervul alveolar inferior, sinusul maxilar sau rădăcinile dentare adiacente;
- Determinarea abordării tratamentului: chirurgical versus non-chirurgical; și
- Furnizarea unei imagini de urmărire pentru a determina gradul de vindecare și posibila nevoie
pentru a retrata o leziune.
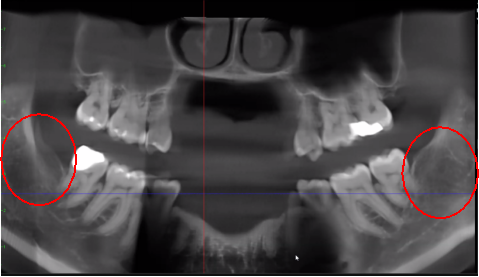
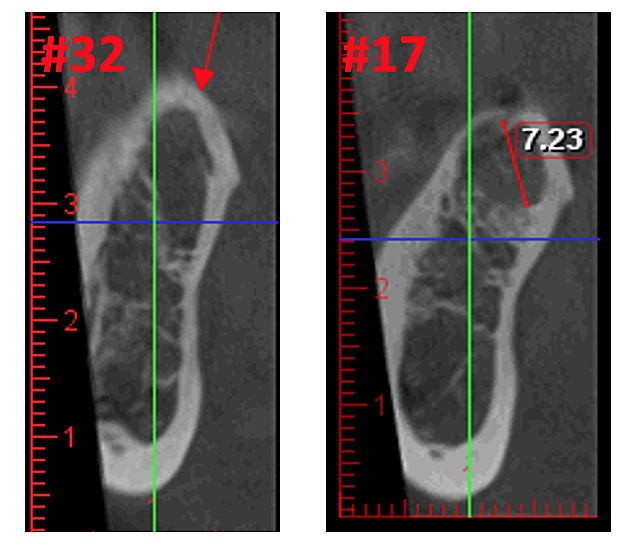
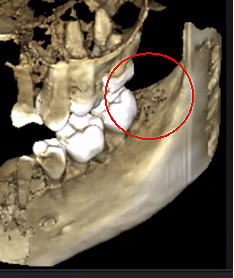
Figura 3 Claritate îmbunătățită a imaginii CBCT datorită tehnologiei software rafinate, care reduce artefactele și „zgomotul” pe care implanturile dentare și restaurările metalice le pot provoca în imagine. Acest lucru permite dentistului și pacientului să vizualizeze mai ușor leziunea. Panoul de sus este o vedere panoramică a unui CBCT care arată locația din stânga (#17) și dreapta (#32) și extinderea leziunilor cavitaționale la un pacient cu osteonecroză a maxilarului. Panoul din stânga jos este o vedere sagitală a fiecărui site. Panoul din dreapta jos este o redare 3-D a locului #17 care arată porozitatea corticală care se află deasupra cavitației medulare. Prin amabilitatea Dr. Reese.
De asemenea, menționăm pe scurt aici un dispozitiv cu ultrasunete, CaviTAU™®, care a fost dezvoltat și este utilizat în anumite părți ale Europei, în special pentru detectarea zonelor cu densitate osoasă scăzută ale oaselor maxilarului superior și inferior, care sugerează cavitații ale maxilarului. Acest dispozitiv de sonografie ultrasonică trans-alveolară (TAU-n) este potențial egal în comparație cu CBCT în detectarea defectelor măduvei maxilarului și are avantajul suplimentar de a expune pacientul la niveluri mult mai scăzute de radiații. Acest dispozitiv nu este în prezent disponibil în SUA, dar este în curs de revizuire de către Administrația pentru Alimente și Medicamente din SUA și ar putea foarte bine să fie instrumentul de diagnostic primar utilizat în America de Nord pentru a trata CIMJD.
Biomarkeri și examen histologic
Datorită naturii inflamatorii a cavitațiilor maxilarului, Lechner și Baehr, 2017 au investigat posibila relație dintre citokinele selectate și boală. O citokină de interes deosebit este „reglată la activare, celulele T normale exprimate și secretate” (RANTES). Această citokină, precum și factorul de creștere a fibroblastelor (FGF)-2, este exprimată în cantități mai mari în leziunile cavitaționale și la pacienții cu CIMDJ. Figura 4, furnizată de dr. Lechner, compară nivelurile de RANTES la pacienții cu cavitații (bară roșie, stânga) cu nivelurile la martorii sănătoși (bara albastră), arătând niveluri care sunt de peste 25 de ori mai mari la cei cu boală. Lechner și colab. utilizează două abordări pentru a măsura nivelurile de citokine. Una este de a măsura nivelurile de citokine sistemic din sânge (Laboratorul de soluții de diagnosticare, SUA.). O a doua metodă este de a preleva o biopsie direct de la locul bolnav atunci când este accesată pentru a fi evaluată de un patolog oral. Din păcate, în acest moment, prelevarea de țesut localizată necesită procesare și transport complexe, care nu au fost încă realizate în facilități care nu sunt de cercetare, dar a oferit corelații perspicace.
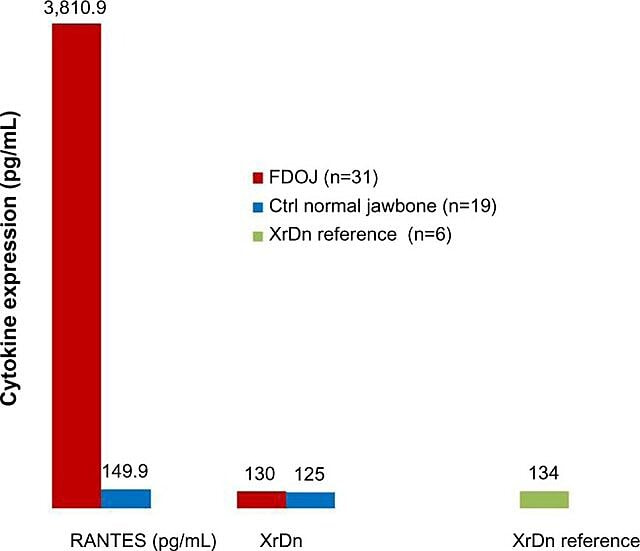
Figura 4 Distribuția RANTES în 31 de cazuri FDOJ și 19 probe de os maxilar normal în comparație cu o referință de densitate de raze X pentru ambele grupuri în zonele corespunzătoare. Abrevieri: RANTES, reglat la activare, ligandul 5 de chemokină normală exprimată și secretată de celule T (motiv CC); XrDn, densitatea razelor X; FDOJ, osteonecroza grasă degenerativă a osului maxilar; n, număr; Ctrl, control. Cifra oferită de dr. Lechner. Numărul de licență: CC BY-NC 3.0
Considerații în evoluție în scopuri de diagnostic
Prezența cavitațiilor oaselor maxilare a fost bine stabilită clinic. Cu toate acestea, diagnosticele clare și parametrii de tratament de cea mai bună practică necesită cercetări suplimentare. Având în vedere acest lucru, este necesar să menționăm pe scurt câteva tehnici interesante și potențial valoroase care sunt folosite de unii practicieni.
Este recunoscut că evaluările fiziologice suplimentare ar fi un instrument valoros de screening și diagnostic. Un astfel de instrument folosit de unii practicieni este imagistica termografică. Activitatea inflamatorie generalizată poate fi observată prin măsurarea diferențelor de căldură pe suprafața capului și a gâtului. Termografia este sigură, rapidă și poate avea valoare diagnostică similară cu cea a CBCT. Un dezavantaj semnificativ este că îi lipsește definiția, ceea ce face dificilă discernământul marginii sau întinderea unei leziuni.
Evaluarea meridianului prin acupunctură
Unii practicieni analizează profilul energetic al unei leziuni utilizând Evaluarea Meridianului de Acupunctură (AMA) pentru a determina efectul acesteia asupra meridianului energetic corespunzător. Acest tip de evaluare se bazează pe Electroacupunctură Conform Voll (EAV). Această tehnică, care se bazează pe medicina chineză veche și principiile acupuncturii, a fost dezvoltată și este predată în SUA. Acupunctura a fost folosită pentru a atenua durerea și pentru a promova vindecarea. Se bazează pe echilibrul fluxului de energie (adică, Chi) prin căi specifice de energie din organism. Aceste căi sau meridiane conectează anumite organe, țesuturi, mușchi și oase între ele. Acupunctura folosește puncte foarte specifice de pe un meridian pentru a influența sănătatea și vitalitatea tuturor elementelor corpului de pe acel meridian. Această tehnică a fost folosită pentru a dezvălui boala maxilarului, care, atunci când este rezolvată, tratează și boli aparent fără legătură, cum ar fi artrita sau sindromul de oboseală cronică. Această tehnică se pretează la investigații suplimentare (adică, rezultatele trebuie documentate și datele longitudinale obținute și diseminate).
Există mulți factori individuali care cresc riscul de dezvoltare a cavitațiilor maxilarului, dar de obicei riscul este multifactorial. Riscurile pentru individ pot fi fie influențe externe, cum ar fi factorii de mediu, fie influențe interne, cum ar fi o funcție imună slabă. Tabelele 2 și 3 prezintă factorii de risc externi și interni.


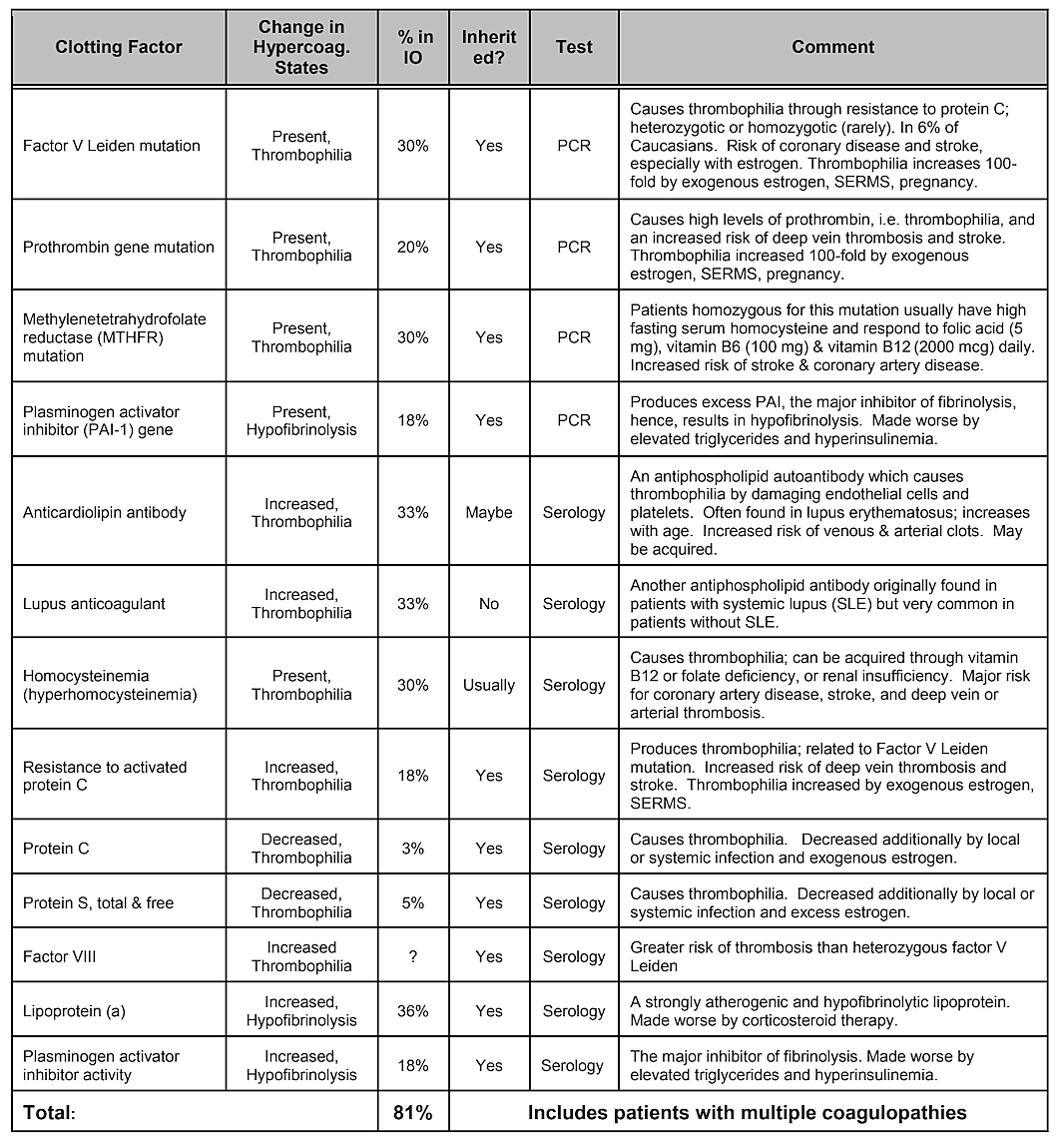
Rețineți că Tabelul 2, Factori interni de risc, nu include predispoziția genetică. În timp ce s-ar crede că variațiile genetice joacă un rol, nici o variație a unei gene sau chiar o combinație de gene nu s-a dovedit a fi identificată ca factor de risc, totuși influențele genetice sunt probabile . O analiză sistematică a literaturii efectuată în 2019 a arătat că au fost identificate un număr de polimorfisme de nucleotide unice, dar nu există nicio replicare între studii. Autorii au concluzionat că, având în vedere diversitatea genelor care au arătat asocieri pozitive cu cavitațiile și lipsa de reproductibilitate a studiilor, rolul jucat de cauzele genetice ar părea a fi moderat și eterogen. Cu toate acestea, țintirea unor populații specifice poate fi necesară pentru a identifica diferențele genetice. Într-adevăr, așa cum s-a demonstrat, unul dintre mecanismele fiziopatologice cele mai comune și de bază ale leziunii osoase ischemice este coagularea în exces din stările de hipercoagulare, care au de obicei baze genetice, așa cum este descris de Bouquot și Lamarche (1999). Tabelul 4 oferit de Dr. Bouquot, enumeră stările de boală care implică hipercoagulare, iar următoarele 3 paragrafe oferă o imagine de ansamblu asupra unora dintre constatările Dr. Bouquot pe care le-a prezentat în rolul său de Director de Cercetare la Centrul Maxilofacial pentru Educație și Cercetare.
În cavitațiile maxilarului există dovezi clare de osteonecroză ischemică, care este o boală a măduvei osoase în care osul devine necrotic din cauza lipsei de oxigen și nutrienți. După cum am menționat, mulți factori pot interacționa pentru a produce cavitații și până la 80% dintre pacienți au o problemă, de obicei moștenită, de producție excesivă de cheaguri de sânge în vasele lor de sânge. Această boală nu este dezvăluită în mod normal în timpul analizelor de sânge de rutină. Osul este deosebit de susceptibil la această problemă de hipercoagulare și dezvoltă vase de sânge foarte dilatate; presiuni interne crescute, adesea dureroase; stagnarea sângelui; și chiar infarcte. Această problemă de hipercoagulare ar putea fi sugerată de antecedentele familiale de accident vascular cerebral și infarct miocardic la o vârstă fragedă (mai puțin de 55 de ani), protecția șoldului sau „artrita” (mai ales la o vârstă fragedă), osteonecroză (mai ales la o vârstă fragedă), profundă tromboză venoasă, embolii pulmonare (cheaguri de sânge în plămâni), tromboză venoasă retiniană (cheaguri în retina ochiului) și avort spontan recurent. Maxilarele au 2 probleme specifice cu această boală: 1) odată deteriorat, osul bolnav nu este capabil să reziste la infecții de grad scăzut de la bacteriile dinților și gingiilor; și 2) osul s-ar putea să nu-și revină din fluxul sanguin diminuat indus de anestezicele locale utilizate de stomatologi în timpul lucrărilor dentare. Figura 5 oferă o vedere microscopică a unui tromb intravascular.
Tabelul 4 Stări de boală care implică hipercoagulare. Patru din cinci pacienți cu cavitație a maxilarului au una dintre aceste coagulare
probleme de factori.
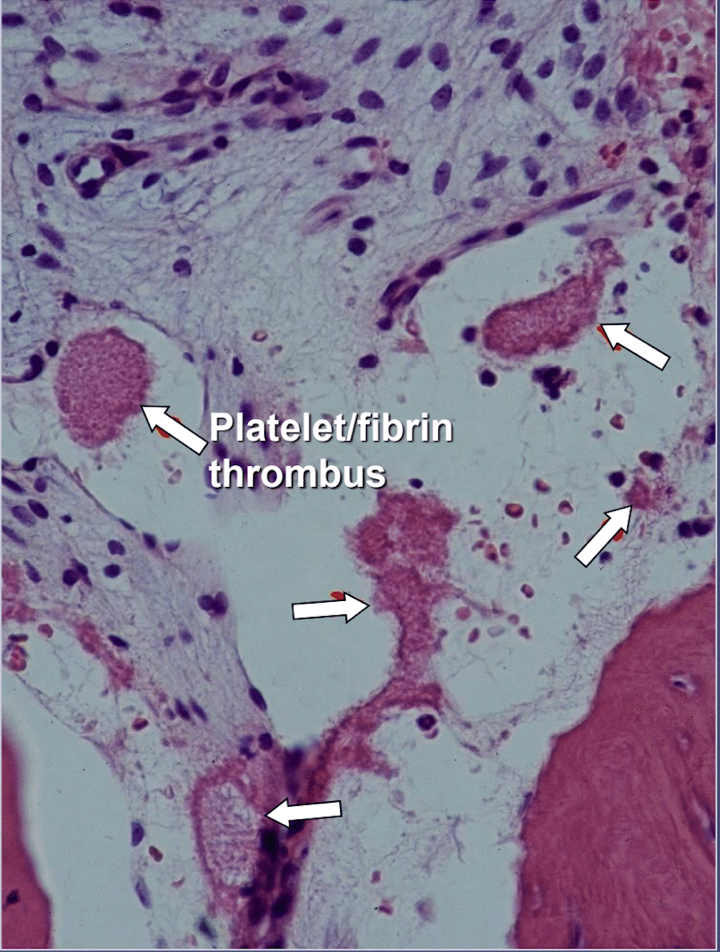
Indiferent de cauza care stă la baza hipercoagulării, osul dezvoltă fie o măduvă fibroasă (fibrele pot trăi în zone lipsite de nutrienți), o măduvă grasă moartă („putregaiul umed”), o măduvă foarte uscată, uneori piele („putregaiul uscat” ), sau un spațiu de măduvă complet gol („cavitație”).
Orice os poate fi afectat, dar cel mai adesea sunt implicate șoldurile, genunchii și maxilarele. Durerea este adesea severă, dar aproximativ 1/3rd dintre pacienți nu simt durere. Organismul are probleme în a se vindeca de această boală și 2/3rds din cazuri necesită îndepărtarea chirurgicală a măduvei lezate, de obicei prin răzuire cu chiurete. Chirurgia va elimina problema (și durerea) în aproape 3/4asta dintre pacienții cu afectare a maxilarului, deși intervențiile chirurgicale repetate, de obicei proceduri mai mici decât prima, sunt necesare la 40% dintre pacienți, uneori în alte părți ale maxilarului, deoarece boala are atât de frecvent leziuni „sărite” (adică, mai multe locuri în oase identice sau asemănătoare), cu măduvă normală între. Mai mult de jumătate dintre pacienții de șold vor avea în cele din urmă boala în șoldul opus. Mai mult de 1/3rd dintre pacienții maxilar vor primi boala în alte cadrane ale maxilarului. Recent, s-a constatat că 40% dintre pacienții cu osteonecroză, fie a șoldului, fie a maxilarului, vor răspunde la anticoagularea cu heparină cu greutate moleculară mică (Lovenox) sau Coumadin cu rezoluția durerii și cu vindecarea osoasă.
Figura 5 Vedere microscopică a trombilor intravasculari
Dacă se caută o abordare non-farmaceutică pentru reducerea riscului de hipercoagulare, se poate lua în considerare utilizarea unor enzime suplimentare, cum ar fi nattokinaza sau lumbrokinaza mai puternică, ambele având proprietăți fibrinolitice și anticoagulante. În plus, stările de deficit de cupru, care sunt asociate cu disfuncția coagulării, ar trebui excluse din cauza riscului crescut de hipercoagulare observat la pacienții cu cavitații ale maxilarului.
IMPLICAȚII SISTEMICE ȘI CLINICE
Prezența cavitațiilor oaselor maxilare și patologia asociată acestora cuprind unele simptome specifice, dar includ adesea și unele simptome sistemice nespecifice. Astfel, diagnosticul și tratamentul acestuia trebuie abordate cu o atenție atentă de către echipa de îngrijire. Cele mai unice și inovatoare realizări care au ieșit la iveală de la documentul de poziție IAOMT 2014 este rezolvarea unor afecțiuni inflamatorii cronice aparent fără legătură în urma tratamentului de cavitație. Indiferent dacă bolile sistemice sunt de natură autoimună sau inflamația care apar altfel, au fost raportate îmbunătățiri semnificative, inclusiv ameliorarea cancerului. Complexul de simptome asociat acestor leziuni este foarte individualizat și, prin urmare, nu poate fi generalizat sau ușor de recunoscut. Prin urmare, IAOMT este de părere că atunci când un pacient este diagnosticat cu cavitații ale maxilarului cu sau fără durere localizată asociată și are, de asemenea, alte boli sistemice care nu au fost atribuite anterior cavitațiilor maxilarului, pacientul are nevoie de o evaluare suplimentară pentru a determina dacă boala este asociată cu , sau este o consecință a bolii. IAOMT și-a chestionat membrii pentru a afla mai multe despre ce simptome/boli sistemice se rezolvă în urma intervenției chirurgicale cavitaționale. Rezultatele sunt prezentate în Anexa I.
Prezența citokinelor generate în leziunile necrotice slab vascularizate ale cavitațiilor maxilarului pare să funcționeze ca un focar al citokinelor inflamatorii care mențin alte zone de inflamație active și/sau cronice. Se speră și se așteaptă ameliorarea sau cel puțin ameliorarea durerii localizate de maxilar după tratament, dar această teorie focală a inflamației, care va fi discutată în detaliu mai jos, poate explica de ce atât de multe boli aparent „neînrudite” care au legături cu afecțiuni inflamatorii cronice. sunt, de asemenea, diminuate cu tratamentul de cavitație.
În sprijinul concluziilor trase în documentul de poziție al IAOMT din 2014, care leagă cavitațiile maxilarului și bolile sistemice, cercetările și studiile clinice publicate mai recent de Lechner, von Baehr și alții, arată că leziunile de cavitație ale maxilarului conțin un profil specific de citokine neobservat în alte patologii osoase. . În comparație cu probele sănătoase de maxilar, patologiile de cavitație arată în mod continuu o puternică reglare în creștere a factorului de creștere a fibroblastelor (FGF-2), a antagonistului receptorului de interleukină 1 (Il-1ra) și, de o importanță deosebită, a RANTES. RANTES, cunoscut și ca CCL5 (cc motiv Ligand 5) a fost descris ca o citokină chemotactică cu o acțiune proinflamatoare puternică. S-a demonstrat că aceste chemokine interferează în mai multe etape ale răspunsului imun și sunt implicate substanțial în diferite stări patologice și infecții. Studiile au arătat că RANTES este implicat în multe boli sistemice, cum ar fi artrita, sindromul de oboseală cronică, dermatita atopică, nefrita, colita, alopecia, tulburările tiroidiene și promovarea sclerozei multiple și a bolii Parkinson. Mai mult, s-a demonstrat că RANTES provoacă o accelerare a creșterii tumorii.
Factorii de creștere a fibroblastelor au fost, de asemenea, implicați în cavitațiile oaselor maxilare. Factorii de creștere a fibroblastelor, FGF-2 și receptorii lor asociați, sunt responsabili pentru multe funcții cruciale, inclusiv proliferarea celulelor, supraviețuirea și migrarea. Ele sunt, de asemenea, susceptibile de a fi deturnate de celulele canceroase și de a juca un rol oncogen în multe tipuri de cancer. De exemplu, FGF-2 promovează progresia tumorii și a cancerului în cancerul de prostată. În plus, nivelurile de FGF-2 au arătat o corelație directă cu progresia, metastazele și prognosticul slab de supraviețuire la pacienții cu cancer colorectal. În comparație cu martorii fără cancer, pacienții cu carcinom gastric au niveluri semnificativ mai mari de FGF-2 în ser. Acești mesageri inflamatori au fost implicați în multe boli grave, fie că sunt de natură inflamatorie sau canceroase. Spre deosebire de RANTES/CCL5 și FGF-2, s-a demonstrat că IL1-ra acționează ca un mediator antiinflamator puternic, contribuind la lipsa semnelor inflamatorii comune în unele leziuni de cavitație.
Nivelurile excesive de RANTES și FGF-2 în leziunile de cavitație au fost comparate și legate de nivelurile observate în alte boli sistemice, cum ar fi scleroza laterală amiotrofică (ALS), scleroza multiplă (SM), artrita reumatoidă și cancerul de sân. Într-adevăr, nivelurile acestor mesageri detectate în cavitațiile maxilarului sunt mai mari decât în serul și lichidul cefalorahidian al pacienților cu SLA și SM. Cercetările actuale realizate de Lechner și von Baehr au demonstrat o creștere de 26 de ori a RANTES în leziunile osteonecrotice ale maxilarului la pacienții cu cancer de sân. Lechner si colegii sai sugereaza ca RANTES derivate de cavitatie poate servi ca un accelerator de dezvoltare si progresia cancerului de san.
După cum am menționat mai devreme, există numeroase cazuri de cavitații asimptomatice ale maxilarului. În aceste cazuri, citokinele proinflamatorii acute, cum ar fi TNF-alfa și IL-6, NU sunt observate în număr crescut în constatările patohistologice ale probelor de cavitație. La acești pacienți, absența acestor citokine pro-inflamatorii este asociată cu niveluri ridicate de antagonist al receptorului 1 de interleukină (Il-1ra) al citokinei antiinflamatorii. Concluzia rezonabilă este că inflamația acută asociată cu cavitațiile maxilarului este sub controlul unor niveluri ridicate de RANTES/FGF-2. Ca rezultat, pentru a pune un diagnostic, Lechner și von Baehr sugerează de-sublinierea accentului pe prezența inflamației și luarea în considerare a căii de semnalizare, în primul rând prin supraexprimarea RANTES/FGF-2. Nivelurile ridicate de RANTES/FGF-2 la pacienții cu cavitație indică faptul că aceste leziuni ar putea cauza căi de semnalizare patogene similare și care se întăresc reciproc către alte organe. Sistemul imunitar este activat ca răspuns la semnalele de pericol, care evocă diverse căi moleculare înnăscute care culminează cu producerea de citokine inflamatorii și posibila activare a sistemului imunitar adaptativ. Acest lucru susține ideea și teoria conform căreia cavitațiile osoase ale maxilarului pot servi ca o cauză fundamentală a bolilor inflamatorii cronice prin producția de RANTES/FGF-2 și explică în continuare de ce simptomele acute ale inflamației nu sunt întotdeauna văzute sau simțite de pacient în leziunile maxilarului. înșiși. Astfel, cavitațiile maxilarului și acești mesageri implicați reprezintă un aspect integrator al bolii inflamatorii și servesc ca o potențială etiologie a bolii. Îndepărtarea cavitațiilor poate fi o cheie pentru a inversa bolile inflamatorii. Acest lucru este susținut de observarea unei reduceri a nivelurilor serice de RANTES după intervenția chirurgicală la 5 paciente cu cancer de sân (vezi tabelul 5). Cercetările ulterioare și testarea nivelurilor RANTES/CCL5 pot oferi o perspectivă asupra acestei relații. Observațiile încurajatoare sunt îmbunătățirile calității vieții realizate de mulți pacienți cu cavitație a maxilarului, fie că este vorba de ameliorarea la locul operației sau de diminuarea inflamației cronice sau a bolii în altă parte.
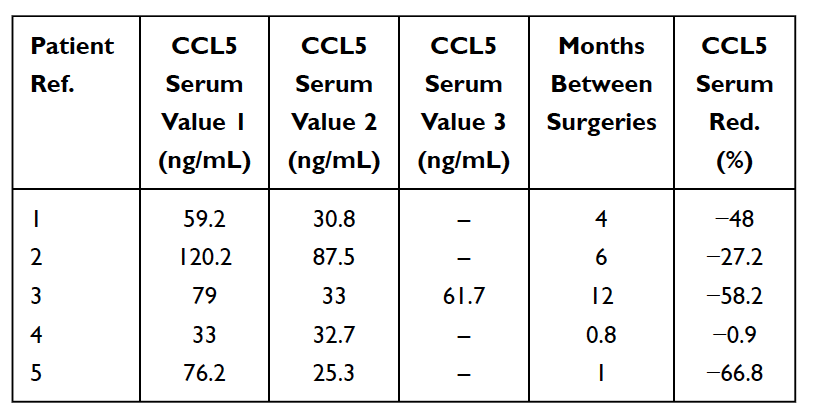
Tabelul 5
Reducerea (roșu) în RANTES/CCL5 în ser la 5 pacienți cu cancer de sân care au suferit o intervenție chirurgicală pentru osteonecroza graso-degenerativă a maxilarului (FDOJ). Tabel adaptat din
Lechner et al, 2021. Cavitația maxilarului exprimat RANTES/CCL5: Studii de caz care leagă inflamația silențioasă în osul maxilarului cu epistemologia cancerului de sân.” Cancerul de sân: ținte și terapie.
Din cauza deficitului de literatură privind tratamentul leziunilor cavitaționale, IAOMT și-a chestionat membrii pentru a aduna informații cu privire la tendințele și tratamentele care se dezvoltă către un „standard de îngrijire”. Rezultatele sondajului sunt discutate pe scurt în Anexa II.
Odată ce localizarea și dimensiunea leziunilor sunt determinate, sunt necesare modalități de tratament. IAOMT este de părere că este în general inacceptabil să lăsați „os mort” în corpul uman. Acest lucru se bazează pe date care sugerează că cavitațiile maxilarului pot fi focarele pentru citokine și endotoxine sistemice pentru a începe procesul de degradare a sănătății generale a pacientului.
În circumstanțe ideale, ar trebui efectuată o biopsie pentru a confirma diagnosticul oricărei patologii a maxilarului și pentru a exclude alte stări de boală. Apoi, este necesar un tratament pentru eliminarea sau eliminarea patologiei implicate și stimularea recreșterii osului normal, vital. În acest moment, în literatura de specialitate, terapia chirurgicală constând în excizia osului nevital afectat pare a fi tratamentul preferat pentru cavitațiile maxilarului. Tratamentul implică utilizarea de anestezice locale, ceea ce duce la o considerație importantă. Se credea anterior că anestezicele care conțin epinefrină, care au proprietăți vasoconstrictoare cunoscute, ar trebui evitate la pacienții care ar putea avea deja fluxul sanguin compromis asociat cu starea lor de boală. Cu toate acestea, într-o serie de studii moleculare, diferențierea osteoblastică a crescut odată cu utilizarea epinefrinei. Prin urmare, clinicianul trebuie să stabilească de la caz la caz dacă să folosească epinefrină și, dacă da, cantitatea care ar trebui utilizată care va da cele mai bune rezultate.
După decorticarea chirurgicală și chiuretajul complet al leziunii și irigarea cu soluție salină normală sterilă, vindecarea este îmbunătățită prin plasarea grefelor de fibrină bogată în trombocite (PRF) în golul osos. Utilizarea concentratelor de fibrină bogate în trombocite în procedurile chirurgicale nu este benefică numai din punct de vedere al coagularii, ci și din punctul de vedere al eliberării factorilor de creștere pe o perioadă de până la paisprezece zile după intervenție chirurgicală. Înainte de utilizarea grefelor PRF și a altor terapii adjuvante, recidiva leziunii osteonecrotice a maxilarului după intervenție chirurgicală a apărut în până la 40% din cazuri.
O examinare a factorilor de risc externi evidențiați în Tabelul 2 sugerează cu tărie că rezultatele nefavorabile pot fi evitate prin tehnica chirurgicală adecvată și interacțiunea medic/pacient, în special în populațiile susceptibile. Este recomandabil să luați în considerare adoptarea unor tehnici atraumatice, minimizarea sau prevenirea bolilor parodontale și a altor boli dentare și alegerea unui armament care să permită cele mai bune rezultate de vindecare. Furnizarea de instrucțiuni detaliate pre- și post-operatorii pacientului, inclusiv riscurile asociate cu fumatul, poate ajuta la minimizarea rezultatelor negative.
Ținând cont de lista largă a potențialilor factori de risc enumerați în Tabelele 2 și 3, se recomandă consultarea cu echipa de îngrijire extinsă a pacientului pentru a stabili în mod corespunzător orice posibili factori de risc ascunși care pot contribui la dezvoltarea cavitațiilor maxilarului. De exemplu, o considerație importantă atunci când se tratează cavitațiile oaselor maxilare este dacă individul ia antidepresive, în special inhibitori selectivi ai recaptării serotoninei (ISRS). ISRS au fost asociate cu o densitate redusă a masei osoase și rate crescute de fracturi. SSRI Fluoxetina (Prozac) inhibă direct diferențierea și mineralizarea osteoblastelor. Cel puțin două studii independente care examinează utilizatorii de SSRI în comparație cu martorii au arătat că utilizarea SRRI este asociată cu indici morfometrici panoramici mai slabi.
Precondiționarea poate contribui, de asemenea, la rezultate de succes ale tratamentului. Aceasta presupune crearea unui mediu tisular propice vindecării prin furnizarea corpului cu niveluri adecvate de nutrienți corespunzători care îmbunătățesc terenul biologic prin optimizarea homeostaziei în organism. Tacticile de precondiționare nu sunt întotdeauna posibile sau acceptabile pentru pacient, dar sunt mai importante pentru acei pacienți care au sensibilități cunoscute, cum ar fi cei cu predispoziție genetică, tulburări de vindecare sau sănătate compromisă. În astfel de cazuri, este esențial ca această optimizare să aibă loc pentru a minimiza nivelurile de stres oxidativ, care nu numai că poate stimula procesul de boală, dar poate interfera cu vindecarea dorită.
În mod ideal, reducerea oricărei încărcături toxice pe corp, cum ar fi fluorul și/sau mercurul din obturațiile dentare cu amalgam ar trebui să fie finalizată înainte de tratamentul cavitațiilor maxilarului. Mercurul poate înlocui fierul în lanțul de transport de electroni al mitocondriilor. Acest lucru are ca rezultat un exces de fier liber (fier feros sau Fe++), producând specii reactive de oxigen (ROS) dăunătoare, cunoscute și sub numele de radicali liberi, care provoacă stres oxidativ. Excesul de fier în țesutul osos inhibă, de asemenea, funcționarea corectă a osteoblastelor, ceea ce, evident, va avea un efect negativ atunci când se încearcă vindecarea unei tulburări osoase.
Alte deficiențe ar trebui, de asemenea, abordate înainte de tratament. Atunci când există o deficiență de cupru, magneziu și retinol biodisponibile, metabolismul și reciclarea fierului devin dereglate în organism, ceea ce contribuie la excesul de fier liber în locuri greșite, ducând la stres oxidativ și mai mare și la riscul de îmbolnăvire. Mai precis, multe enzime din organism (cum ar fi ceruloplasmina) devin inactive atunci când există niveluri insuficiente de cupru, magneziu și retinol biodisponibile, care apoi perpetuează dereglarea sistemică a fierului și creșterea rezultată a stresului oxidativ și a riscului de îmbolnăvire.
Strategii alternative de tratament
Ar trebui de asemenea evaluate tehnicile alternative care sunt utilizate ca terapii primare sau de susținere. Acestea includ homeopatie, stimulare electrică, terapie cu lumină, cum ar fi fotobiomodularea și laser, oxigen/ozon de calitate medicală, oxigen hiperbaric, modalități de anticoagulare, remedii Sanum, nutriție și nutraceutice, saună cu infraroșii, ozonterapie intravenoasă, tratamente energetice și altele. În acest moment, știința nu a fost efectuată care să confirme că aceste forme alternative de tratament sunt fie viabile, fie ineficiente. Ar trebui stabilite standarde de îngrijire pentru a asigura vindecarea și detoxifierea corespunzătoare. Tehnicile de evaluare a succesului trebuie testate și standardizate. Ar trebui prezentate pentru evaluare protocoale sau proceduri care să ajute la determinarea când tratamentul este adecvat și când nu este adecvat.
Cercetările au arătat că prezența cavitațiilor maxilarului este un proces de boală insidios asociat cu fluxul sanguin redus. Fluxul sanguin medular compromis duce la o vascularizare slab mineralizată și inadecvată în zonele maxilarului care se pot infecta cu agenți patogeni, sporind moartea celulară. Fluxul lent de sânge în leziunile cavitaționale provoacă livrarea de antibiotice, nutrienți și mesageri imuni. Mediul ischemic poate adăposti și promova, de asemenea, mediatori inflamatori cronici care pot avea efecte și mai dăunătoare asupra sănătății sistemice. Predispoziția genetică, funcția imunitară redusă, efectele anumitor medicamente, traume și infecții și alți factori precum fumatul pot instiga sau accelera dezvoltarea cavitațiilor maxilarului.
Alături de eminentul patolog maxilar, dr. Jerry Bouquot, IAOMT prezintă și promovează o identificare corectă histologic și patologic a leziunilor cavitaționale ale maxilarului ca boala medulară ischemică cronică a osului maxilar, CIMDJ. Deși multe nume, acronime și termeni au fost și sunt utilizați în prezent pentru a desemna această boală, IAOMT este convins că acesta este cel mai potrivit termen pentru a descrie starea patologică și micro-histologică întâlnită în mod obișnuit în cavitațiile maxilarului.
Deși majoritatea leziunilor cavitaționale ale maxilarului sunt greu de diagnosticat cu radiografiile de rutină și majoritatea nu sunt dureroase, nu trebuie niciodată să presupunem că procesul bolii nu există. Există multe procese ale bolii care sunt dificil de diagnosticat și multe care nu sunt dureroase. Dacă am folosi durerea ca indicator pentru tratament, boala parodontală, diabetul și majoritatea cancerelor ar rămâne netratate. Medicul stomatologic de astăzi are un spectru larg de modalități pentru a trata cu succes cavitațiile maxilarului și eșecul de a recunoaște boala și de a recomanda tratament nu este mai puțin grav decât eșecul de a diagnostica și trata boala parodontală. Pentru sănătatea și bunăstarea pacienților noștri, o schimbare de paradigmă este crucială pentru toți profesioniștii din domeniul sănătății, inclusiv medicii dentari și medicii, pentru a 1) să recunoască prevalența cavitațiilor maxilarului și 2) să recunoască legătura dintre cavitația maxilarului și bolile sistemice.
REZULTATELE SONDAJULUI IAOMT 2 (2023)
După cum s-a discutat pe scurt în lucrare, afecțiunile neînrudite se remit adesea după intervenția chirurgicală de cavitație. Pentru a afla mai multe despre ce tipuri de afecțiuni se rezolvă și cum are loc remisiunea proximală în legătură cu intervenția chirurgicală, un al doilea sondaj a fost trimis membrilor IAOMT. O listă de simptome și afecțiuni pe care membrii acestui comitet au observat că se îmbunătățesc după intervenția chirurgicală au fost compilate pentru sondaj. Respondenții au fost întrebați dacă au observat remiterea vreuneia dintre aceste afecțiuni după operație și, dacă da, în ce măsură. Ei au fost, de asemenea, întrebați dacă simptomele s-au remis rapid sau dacă îmbunătățirile au durat mai mult de două luni. În plus, respondenții au fost întrebați dacă au efectuat în mod obișnuit o intervenție chirurgicală pe site-uri individuale, mai multe locuri unilaterale sau toate locurile dintr-o singură intervenție chirurgicală. Rezultatele sondajului sunt prezentate în figurile de mai jos. Datele sunt preliminare, având în vedere că numărul de respondenți a fost mic (33) și că lipsesc unele date.
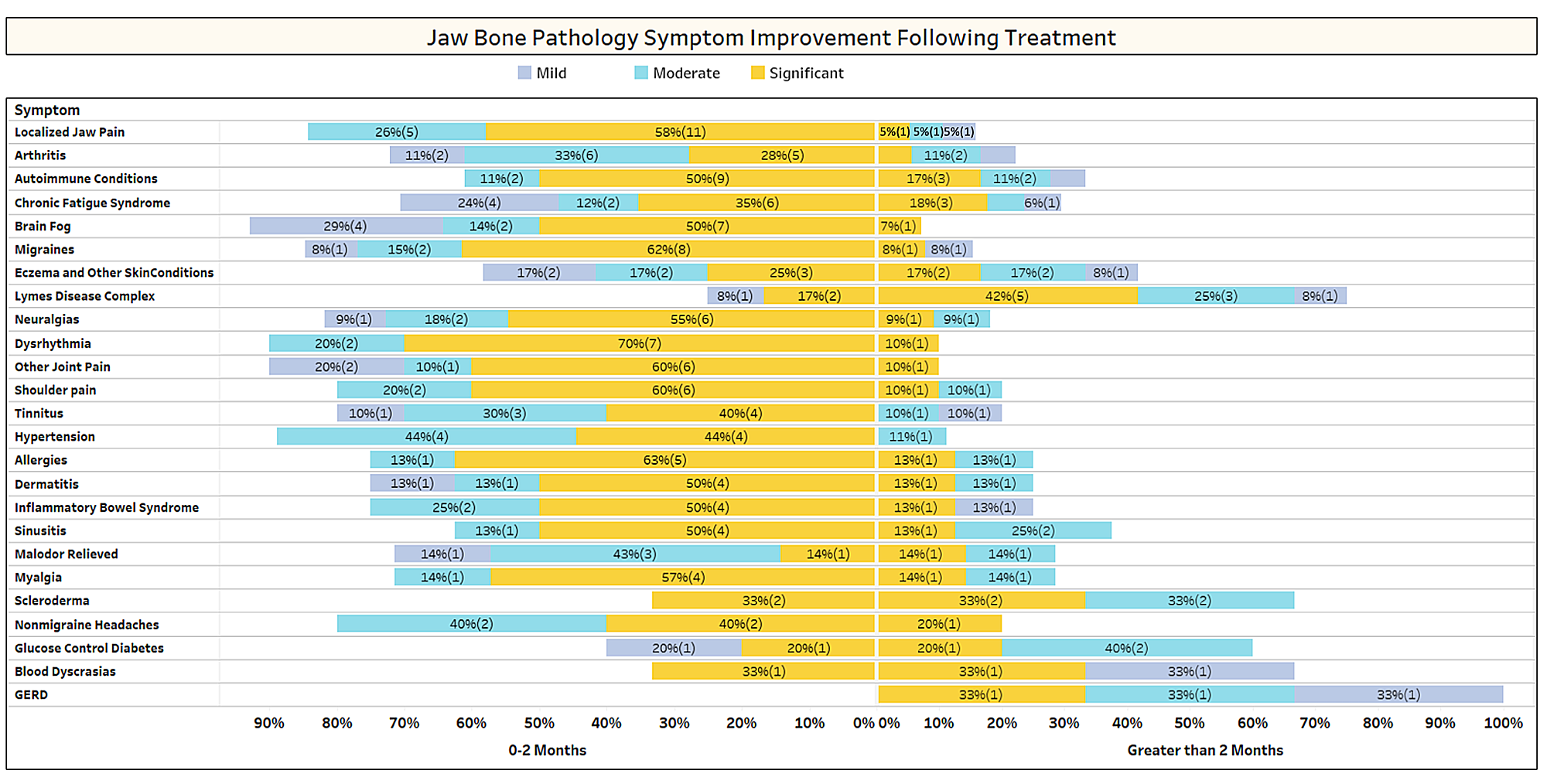
Anexa I Fig 1 Respondenții au evaluat nivelul de îmbunătățire (ușoară, moderată sau semnificativă) și au observat dacă îmbunătățirea a avut loc rapid (0-2 luni) sau a durat mai mult (> 2 luni). Condițiile/simptomele sunt enumerate în ordinea celor mai raportate. Rețineți că majoritatea afecțiunilor/simptomelor s-au remis în mai puțin de două luni (partea stângă a liniei mediane).
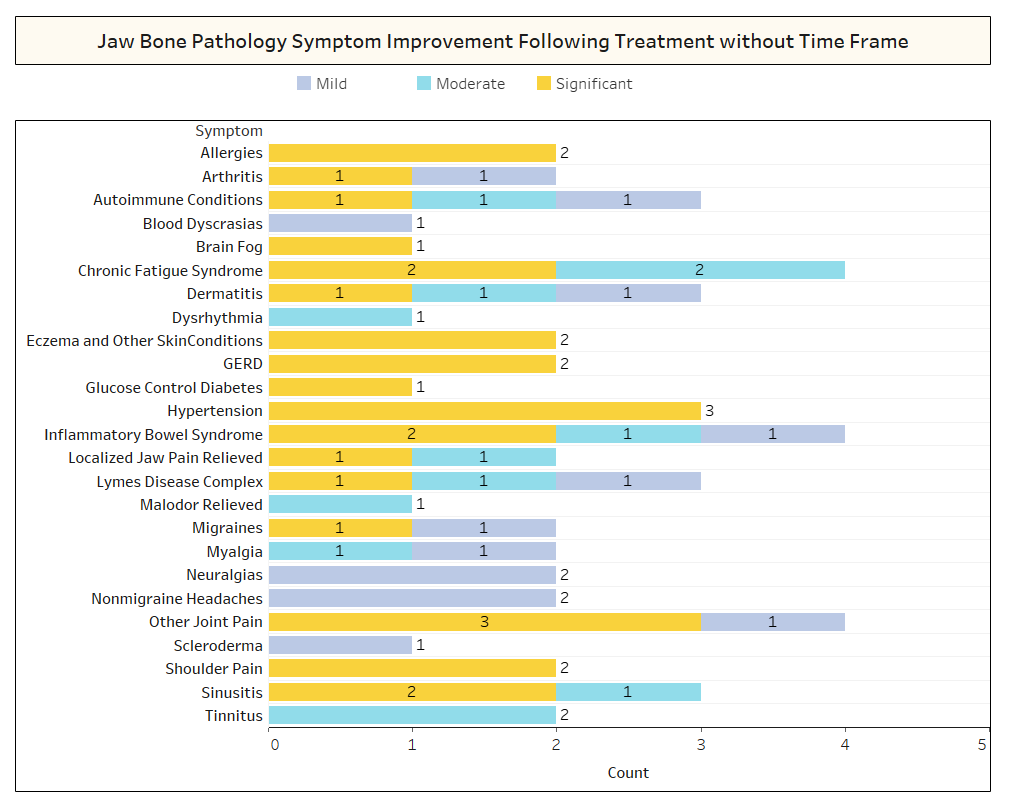
Anexa I Fig 2 După cum sa arătat mai sus, în mai multe cazuri, Respondenții nu au notat intervalul de timp de recuperare pentru îmbunătățirile care au fost observate.
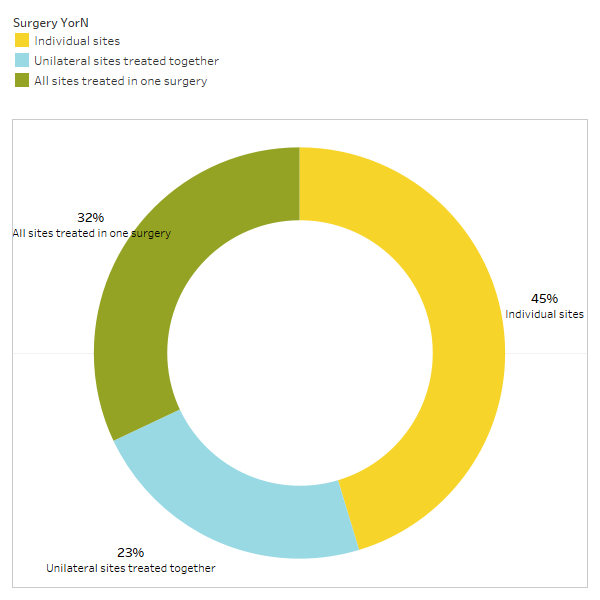
Anexa I Fig 3 Respondenții au răspuns la întrebarea „De obicei, recomandați/efectuați
o intervenție chirurgicală pentru locații individuale, locuri unilaterale tratate împreună sau toate locurile tratate într-o singură intervenție chirurgicală?”
REZULTATELE SONDAJULUI IAOMT 1 (2021)
Datorită deficitului de literatură și recenzii de cazuri clinice referitoare la tratamentul leziunilor cavitaționale, IAOMT și-a chestionat membrii pentru a aduna informații cu privire la tendințele și tratamentele care se dezvoltă către un „standard de îngrijire”. Sondajul complet este disponibil pe site-ul web al IAOMT (rețineți că nu toți practicienii au răspuns la toate întrebările din sondaj).
Pentru a rezuma pe scurt, majoritatea celor 79 de respondenți oferă tratament chirurgical, care implică reflexia țesuturilor moi, accesul chirurgical al locului de cavitație și diferite metode de „curățare” fizică și dezinfectare a locului afectat. O gamă largă de medicamente, nutraceutice și/sau produse din sânge sunt utilizate pentru a promova vindecarea leziunii înainte de închiderea inciziei țesuturilor moi.
Frezele rotative sunt adesea folosite pentru deschiderea sau accesarea leziunii osoase. Majoritatea clinicienilor folosesc un instrument de mână pentru a cureta sau răzui osul bolnav (68%), dar sunt utilizate și alte tehnici și instrumente, cum ar fi o freză rotativă (40%), un instrument piezoelectric (ultrasunet) (35%) sau un Laser ER:YAG (36%), care este o frecvență laser utilizată pentru streaming fotoacustic.
Odată ce site-ul este curățat, debridat și/sau curatat, majoritatea respondenților folosesc apă/gaz cu ozon pentru a dezinfecta și pentru a promova vindecarea. 86% dintre respondenți utilizează PRF (fibrină bogată în trombocite), PRP (plasmă bogată în trombocite) sau PRF sau PRP ozonat. O tehnică promițătoare de dezinfecție raportată în literatură și în cadrul acestui studiu (42%) este utilizarea intraoperatorie a Er:YAG. 32% dintre respondenți nu folosesc niciun tip de grefă osoasă pentru a umple locul de cavitație.
Majoritatea respondenților (59%) nu biopsiază leziunile, indicând o varietate de motive, de la cost, incapacitatea de a obține probe de țesut viabile, dificultatea de a găsi un laborator de patologie sau certitudinea stării bolii.
Majoritatea respondenților nu folosesc antibiotice preoperator (79%), în timpul intervenției chirurgicale (95%) sau postoperator (69%). Un alt suport IV care este utilizat include steroizii dexametazonă (8%) și vitaminele C (48%). Mulți respondenți (52%) utilizează terapia cu laser de nivel scăzut (LLLT) postoperator în scopuri de vindecare. Mulți respondenți recomandă suport nutritiv, inclusiv vitamine, minerale și diverse medicamente homeopatice înainte de (81%) și în timpul (93%) perioadei de vindecare.
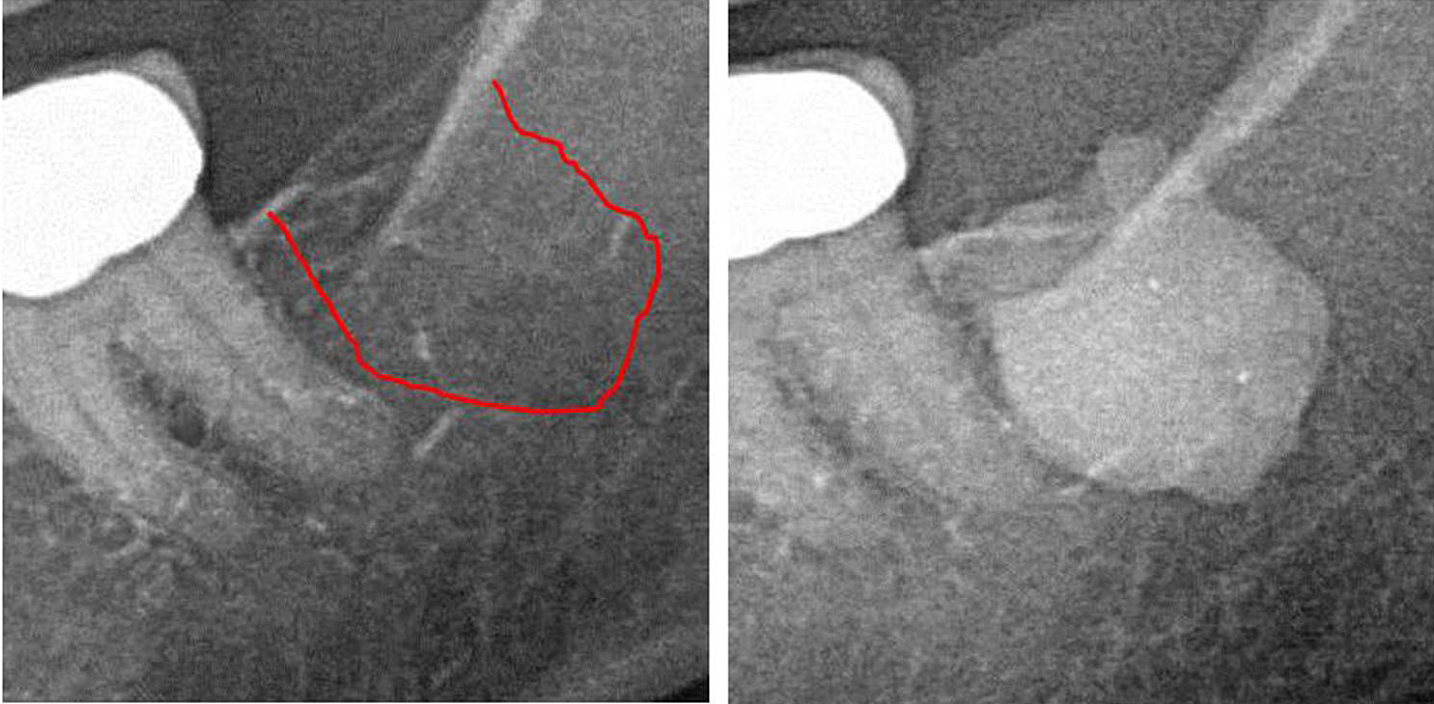 imagini
imagini
Anexa III Fig 1 Panoul din stânga: diagnosticare cu raze X 2D a zonei #38. Panoul din dreapta: Documentarea întinderii FDO) în zona retromolară 38/39 folosind un agent de contrast după intervenția chirurgicală FDOJ.
Abrevieri: FDOJ, osteonecroza degenerativă grasă a osului maxilar.
Adaptat după Lechner, et al, 2021. „Cavitația maxilarului exprimat RANTES/CCL5: Studii de caz care leagă inflamația silențioasă în osul maxilarului cu epistemologia cancerului de sân”. Cancerul de sân: ținte și terapie
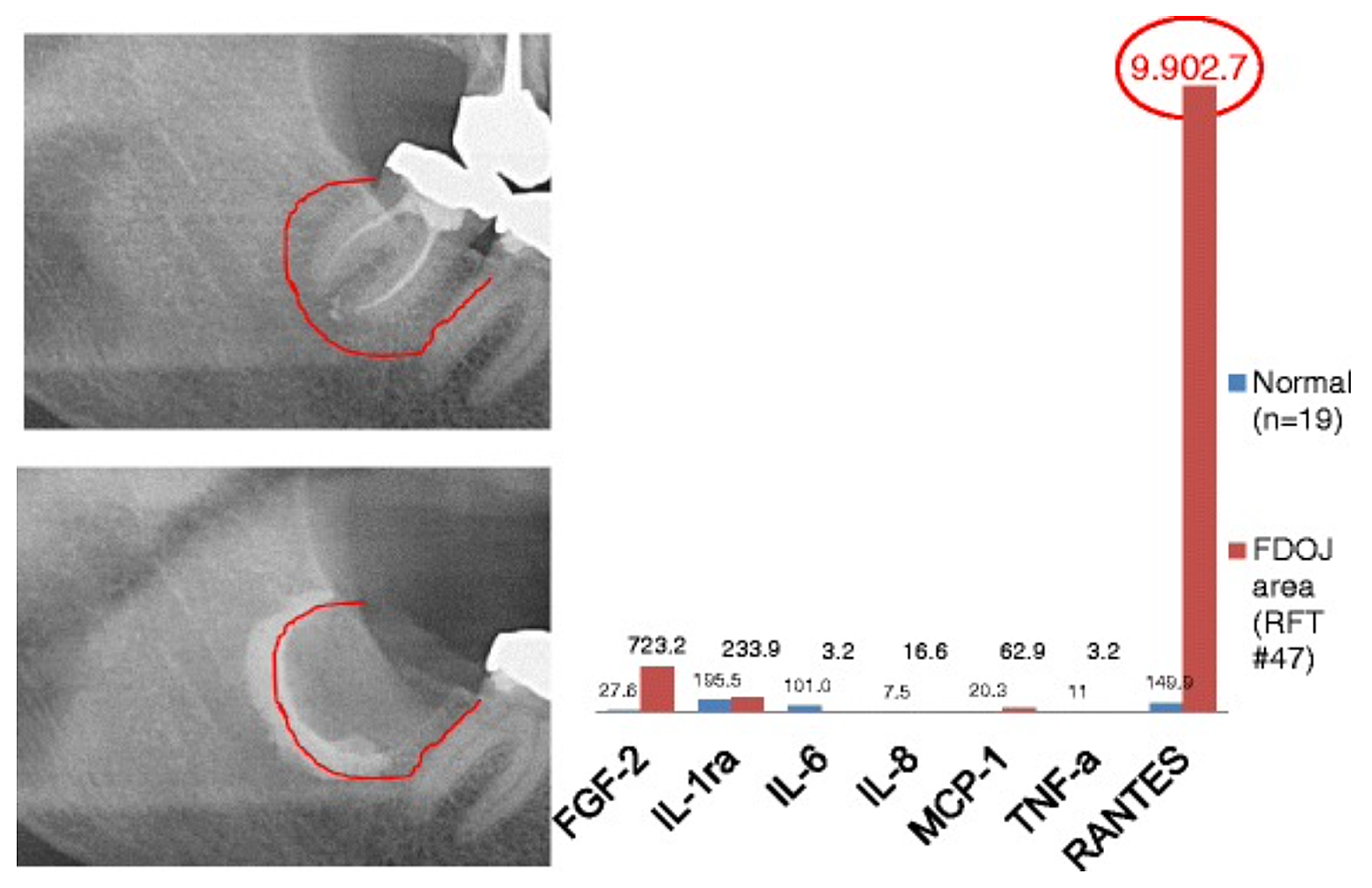
Anexa 3 Fig 2 Comparație a șapte citokine (FGF-2, IL-1ra, IL-6, IL-8, MCP-1, TNF-a și RANTES) în FDOJ sub RFT #47 cu citokinele din osul maxilar sănătos (n = 19). Documentația intraoperatorie a extinderii FDOJ în osul maxilar inferior drept, zona #47 apicală a RFT #47, prin agent de contrast după îndepărtarea chirurgicală a RFT #47.
Abrevieri: FDOJ, osteonecroza degenerativă grasă a osului maxilar.
Adaptat după Lechner și von Baehr, 2015. „Chemokine RANTES/CCL5 as an Unknown Link between Wound Healing in the Jawbone and Systemic Disease: Is Prediction and Tailored Treatments in the Horizon?” Jurnalul EPMA
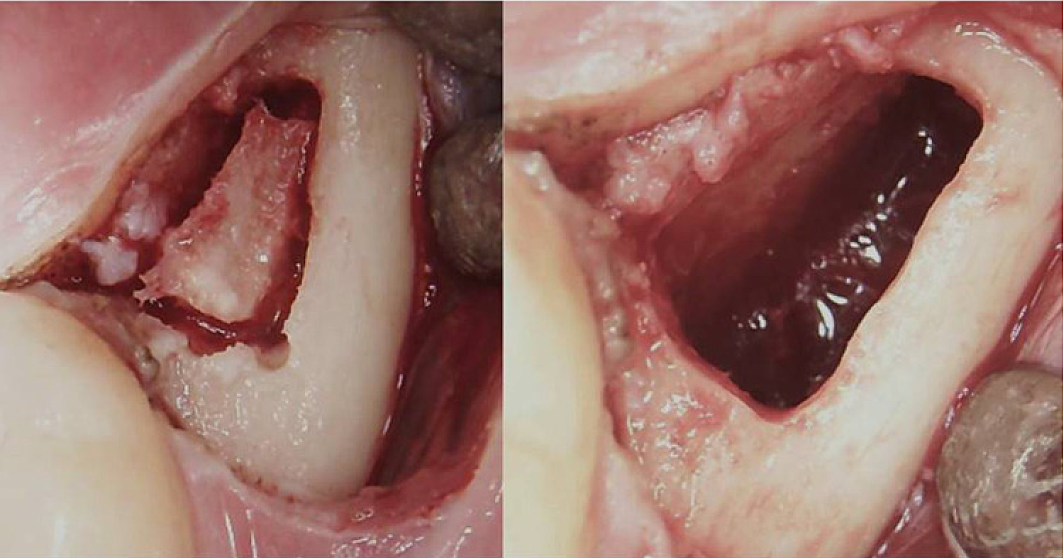
Anexa III Fig 3 Procedura chirurgicală pentru un BMDJ/FDOJ retromolar. Panoul din stânga: după plierea lamboului mucoperiostal, s-a format o fereastră osoasă în cortex. Panoul drept: cavitate medulară curetată.
Abrevieri: BMDJ, defect de măduvă osoasă în osul maxilarului; FDOJ, osteonecroza grasă degenerativă a maxilarului.
Adaptat după Lechner, et al, 2021. „Sindromul de oboseală cronică și defecte ale măduvei osoase ale maxilarului – Un raport de caz privind diagnosticarea suplimentară cu raze X dentare cu ultrasunete”. Jurnalul International Medical Case Reports
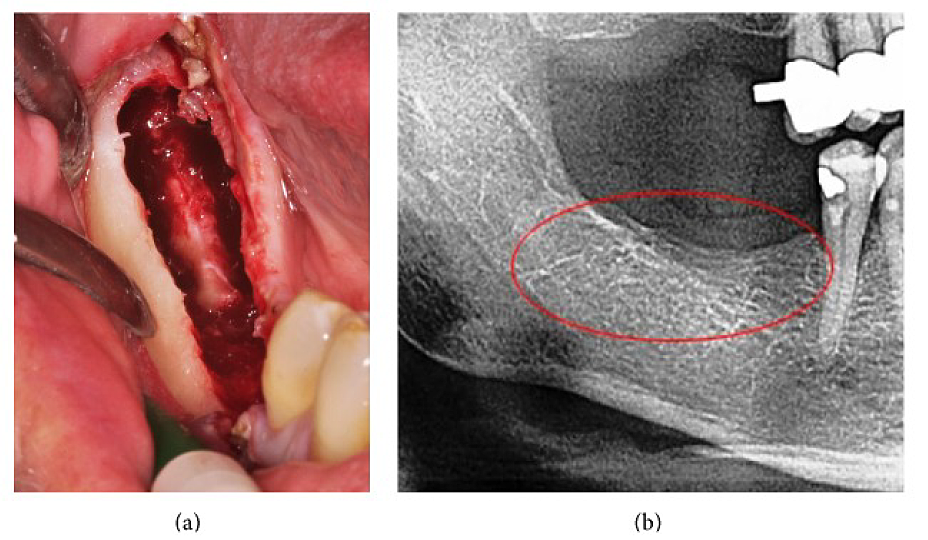
Anexa III Fig 4 (a) Chiuretajul FDOJ în maxilarul inferior cu nervul infra-alveolar denudat. (b) Radiografia corespunzătoare fără semne de proces patologic în osul maxilarului.
Abrevieri: FDOJ, osteonecroza degenerativă grasă a osului maxilar
Adaptat după Lechner, et al, 2015. „Durerea facială/trigemenală neuropatică periferică și RANTES/CCL5 în cavitația maxilarului”. Dovezi bazate pe medicina complementară și alternativă
Anexa III Filmul 1
Clip video (dublu clic pe imagine pentru a vizualiza clipul) de intervenție chirurgicală a maxilarului care arată globule de grăsime și scurgeri purulente din osul maxilarului unui pacient care a fost suspectat de necroză a maxilarului. Prin amabilitatea Dr. Miguel Stanley, DDS
Anexa III Filmul 2
Clip video (dublu clic pe imagine pentru a vizualiza clipul) de intervenție chirurgicală a maxilarului care arată globule de grăsime și scurgeri purulente din osul maxilarului unui pacient care a fost suspectat de necroză a maxilarului. Prin amabilitatea Dr. Miguel Stanley, DDS
Pentru a descărca sau a imprima această pagină într-o altă limbă, alegeți mai întâi limba din meniul derulant din stânga sus.
Document de poziție IAOMT privind cavitațiile maxilarului uman Autori













